郭靖濤/於樂謙團隊合作利用3D重構解析人類原腸運動早期發育過程
人類早期原腸運動決定了細胞如何精確地遷移、定位和分化,形成正常的多胚層結構及器官係統,因此研究人類早期原腸運動的分子規律,對於理解胚胎發育的基本機製至關重要。原腸運動的分子機製涉及細胞間信號傳遞與基因表達的調控,這些都直接影響到個體發育的精確性和穩定性。深入探討這些分子規律,能夠揭示發育異常和先天性畸形的根源,提升我們對人類健康和疾病治療的理解。人類原腸胚形成始於胚胎第14-15天(Carnegie stage,CS6-7),在約第21天(CS9)結束【1】,最終形成三層胚層:外胚層、中胚層和內胚層。然而,早期原腸胚形成的研究仍較為有限,目前僅有少數涵蓋CS5到CS11階段的非人類靈長類胚胎的單細胞轉錄組數據集。最近,同一研究團隊對人類CS8時期胚胎進行了關鍵事件的研究【2】,但許多早期原腸胚事件如前後軸的建立和原始生殖細胞特化等已在更早階段發生。當前唯一可用的關於人類早期原腸胚的數據集是CS7階段的單細胞轉錄組數據【3】,包含1,195個細胞,定義了不同細胞類型,並為體外胚胎模型提供了參考。然而,由於缺乏精確空間信息,細胞類型定義麵臨挑戰。
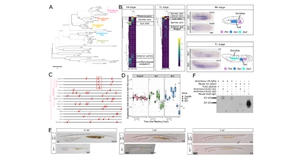
2025年1月10日,必威精装版app西汉姆联 郭靖濤研究員、中國農業大學魏育蕾教授、北京理工大學肖振宇副教授、及必威精装版app西汉姆联 於樂謙研究員合作在Nature Cell Biology上發表了文章Spatial Transcriptomic Characterization of a Carnegie Stage 7 Human Embryo。研究團隊基於CS7時期完整人類胚胎,利用連續橫斷麵(transverse plane)高分辨空間轉錄組切片,結合深度學習算法進行三維對齊,形成了完整胚胎中不同細胞類型與基因表達的三維空間分布點雲圖,數字3D重構了首個完整人類原腸胚模型。
人的生命始於精子與卵子融合形成受精卵(胚胎期第0天;Embryonic day 0;E0),受精卵經曆卵裂形成囊胚,囊胚在E7左右種植到母體子宮進一步發育。E14開始,胚胎經曆原腸運動,胚胎後部細胞發生大規模定向遷移,並形成原條細胞【4】。
本工作發現,胚胎前部細胞分化為外胚層,盡管原條細胞在早期所有類群中都同時具有TBXT/MIXL1等原條的marker,但依據空間位置和DEG進行進一步分群,能發現不同空間位置上就已經開始出現不同類型中胚層的marker表達,證明在原腸運動早期胚胎就已根據的不同有了譜係分化的傾向性。這些在原條細胞類群中從前端自後端可以再細分出的類群包括表達CYP26A1和NODAL的軸向中胚層(Axial Mesoderm)、表達FOXC1/FOXC2的近軸中胚層(Paraxial Mesoderm)、表達HAND1的側板中胚層(Lateral Plate Mesoderm)/胚外中胚層前體細胞(Extraembryonic Mesoderm progenitor)等。
在胚胎發育的早期階段,前內髒內胚層(Anterior Visceral Endoderm,AVE)的遷移行為對於確定胚胎的前後軸向至關重要。AVE不僅在遷移模式上與周圍的內髒內胚層(Visceral Endoderm,VE)有所不同,還具有限製原始條紋在胚胎對側形成的能力【5】。本研究中,研究者首次在人胚胎中證明了AVE的存在,並將該類群細胞與鼠、猴等物種跨物種比較,發現其特征marker非常保守,包含DKK1/OTX2等重要抑製因子和轉錄因子的表達。
最後,該研究借助3D重構原腸胚模型探討了人類原始生殖細胞(Primordial Germ Cells,PGCs)的分子特性。研究發現PGCs在CS7時期位於胚胎尾端,且可能源自外胚層衍生的細胞。通過與體內PGCs、體外人類原始生殖細胞樣細胞(Human Primordial Germ Cell-like Cells,hPGCLCs)對比,驗證了CS7和CS8時期的PGCs在轉錄組特征上與hPGCLCs高度相似(除DMRT1+ hPGCLCs外),進一步揭示了體內和體外PGCs在發育過程中的分子變化,為理解和優化PGC的培養條件提供了重要的見解。
綜上所述,該研究中基於82個連續的冷凍切片進行Stereo-seq測序,重建了人類CS7胚胎的三維模型。本研究發現了不同中胚層亞型的早期命運決定以及前內髒內胚層的存在。本研究還發現原始生殖細胞位於Connecting stalk中,以及在卵黃囊中觀察到造血幹細胞來源的造血現象。這項研究推動了我們對人類原腸胚發育的理解,並為未來早期人類發育研究提供了寶貴的數據集。此外,鑒於3D模型以論文圖片形式展示的挑戰,為了便於更多讀者理解和使用研究結果,論文作者們還同時建立並發布了可互動共享網站:cs7.3dembryo.com.
原文鏈接
https://www.nature.com/articles/s41556-024-01597-3



雄性動物睾丸的主要任務是產生精子——這是形態上最為多樣化的真核細胞之一。精子發生的過程包括精原細胞自我更新、精母細胞減數分裂和精子變形等高度保守的機製,這些過程在物種間高度保守;與此同時,每個物種...

近日,必威精装版app西汉姆联 趙莉藺研究員團隊在生態學國際期刊Global Change Biology在線發表了題為“Vulnerability of global pine forestry's carbon sink to an invasive pathogen-vector system”的研究成果...
胰島素/IGF-1通路對多種動物壽命和衰老速度的影響已在包括線蟲、果蠅和小鼠在內的多種模式生物中得到驗證。同時,多項針對長壽人群的研究已證明人類衰老表型與胰島素/IGF-1信號通路基因的遺傳變異之間存在關聯。

