王金勇團隊開發多能幹細胞來源CRO-CD7 CAR-iNK細胞:避免自相殘殺,延長體內續存、有效抑製T細胞腫瘤
NK細胞是一種固有免疫細胞,具有廣譜殺傷腫瘤細胞的功能,可同種異體輸注,與T細胞相比不易產生移植物抗宿主病(GVHD)和細胞因子釋放綜合征(CRS)等嚴重副作用。近年來,嵌合抗原受體NK細胞(CAR-NK)已在血液係統惡性腫瘤和部分實體瘤中顯示出良好的抗腫瘤活性。人多能幹細胞(hPSC),包括人誘導性多能幹細胞(hiPSC)和人胚幹細胞(hESC),具有無限來源和易於多重基因編輯的優勢。相對於人體組織或NK細胞係來源的CAR-NK細胞,hPSC誘導分化來源的CAR-iNK細胞具備細胞均一性高、製備成本低、可規模化生產、凍存現貨等符合成藥性特點。目前,已建立類器官法誘導hESCs大規模再生iNK、MSLN CAR-iNK和低免疫原性CD19 CAR-iNK細胞的技術和生產工藝,部分細胞製劑已經推進到臨床試驗(IIT)階段【1-3】。然而,同種異體CAR-NK細胞輸注後存在體內續存時間短、療效不持久等問題,亟待解決。
近日,必威精装版app西汉姆联 、北京幹細胞與再生醫學研究院王金勇團隊與上海同濟大學梁愛斌、浙江大學錢文斌、協和醫科院天津血液病醫院竺曉凡等臨床醫學領域科學家合作,在Journal of Hematology & Oncology在線發表了題為Engineered CRO-CD7 CAR-NK cells derived from pluripotent stem cells avoid fratricide and efficiently suppress human T-cell malignancies的研究論文。T細胞急性淋巴細胞白血病(T-ALL)是一種侵襲性的惡性血液腫瘤。CD7蛋白在超過95%的T-ALL和30%的急性髓係白血病(AML)病人中高表達【4】。由於CD7蛋白也表達在正常的T和NK等細胞中,導致人體組織來源CD7 CAR-NK細胞間存在自相殘殺,影響這些細胞的增殖和抗腫瘤效果。已有研究表明,消除CD7膜蛋白表達可有效避免CD7 CAR-T/CAR-NK細胞的自相殘殺。特別地,在造血幹細胞階段敲除CD7基因並不影響T細胞和NK細胞的發育和功能【5】。
該研究利用國家幹細胞資源庫的臨床級hESCs,利用必威精装版app西汉姆联 開發的基因編輯工具,成功開發了CD7基因敲除、導入CD7 CAR的CAR-iNK(CD7 KO-CD7 CAR-iNK)細胞製備技術。首先利用基因編輯與基因工程技術在hESCs階段實現CD7基因敲除並穩定表達CD7 CAR元件,隨後通過類器官誘導技術誘導hESCs高效獲得CD7 KO-CD7 CAR-iNK細胞。CD7 KO-CD7 CAR-iNK細胞可有效避免由CD7抗原介導的CD7 CAR-NK細胞的自相殘殺行為,恢複NK細胞的正常增殖能力(圖2),並對CD7靶點陽性的T-ALL腫瘤細胞係和病人來源的原代T-ALL細胞展現出高效、特異的細胞毒性。
研究表明,NK細胞在體外培養或製備過程中會導致CXCR4(在歸巢至骨髓中起關鍵作用)的表達下調【6】。在CAR-NK細胞中過表達CXCR4,有望促進其歸巢,通過與骨髓微環境互作提高存活、原位增殖和功能活性。該研究進一步在hESCs階段過表達CXCR4,通過iNK類器官誘導技術【1】誘導產生過表達CXCR4的CD7 KO-CD7 CAR-iNK細胞(CRO-CD7 CAR-iNK)。體內生物發光活體成像追蹤實驗證實,CXCR4過表達能夠有效延長CD7 KO-CD7 CAR-iNK細胞的體內續存時間(圖3)。進一步,通過T-ALL細胞荷瘤小鼠模型證實,CRO-CD7 CAR-iNK細胞能夠有效抑製T-ALL荷瘤小鼠的腫瘤生長,顯著延長生存期(圖4)。
綜上所述,該研究通過基因編輯與基因工程成功構建敲除CD7基因並過表達CD7 CAR和CXCR4的CRO-CD7 CAR-hESCs,類器官法誘導其分化產生了免疫表型和功能正常、成功避免自相殘殺的CRO-CD7 CAR-iNK細胞。CRO-CD7 CAR-iNK細胞細胞學水平上在體內外周血循環血的續存時間可延長至28天以上,並顯著延長T-ALL細胞荷瘤小鼠的生存期。該研究開發了hESCs來源的CD7 KO-CD7 CAR-iNK細胞,克服傳統CD7 CAR NK細胞自相殘殺、增殖能力受損、體內持續性差等問題,為治療CD7靶點陽性的T-ALL和AML惡性腫瘤提供了一種有前景的細胞製劑。
必威精装版app西汉姆联 、北京幹細胞與再生醫學研究院王金勇研究員及其團隊的張夢雲副研究員、王童潔副研究員為該論文共同通訊作者,王金勇研究員團隊的博士生林雲輕、肖子芸為該論文共同第一作者。該研究得到科技部國家重點研發計劃幹細胞專項(2024YFA1108302)、國家自然科學基金委傑出青年基金(81925002)等項目資助。
原文鏈接:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-025-01712-3
參考文獻
1. Huang D,Li J,Hu F et al. Lateral plate mesoderm cell-based organoid system for NK cell regeneration from human pluripotent stem cells. Cell Discov 2022;8:121.
2. Zhang Q,et al. Hypoimmunogenic CD19 CAR-NK cells derived from embryonic stem cells suppress the progression of human B-cell malignancies in xenograft animals. Front Immunol. 2024;15:1504459.
3. Liu Y,et al. Mesothelin CAR-engineered NK cells derived from human embryonic stem cells suppress the progression of human ovarian cancer in animals. Cell Prolif. 2024;57: e13727.
4. Campana D,van Dongen JJ,Mehta A,Coustan-Smith E,Wolvers-Tettero IL,Ganeshaguru K,Janossy G. Stages of T-cell receptor protein expression in T-cell acute lymphoblastic leukemia. Blood. 1991;77:1546–54.
5. Kim MY,Cooper ML,Jacobs MT,Ritchey JK,Hollaway J,Fehniger TA,DiPersio JF. CD7-deleted hematopoietic stem cells can restore immunity after CAR T cell therapy. JCI Insight. 2021;6:e149819.
6. Beider K,et al. Involvement of CXCR4 and IL-2 in the homing and retention of human NK and NK T cells to the bone marrow and spleen of NOD/SCID mice. Blood. 2003;102:1951-1958.

圖1
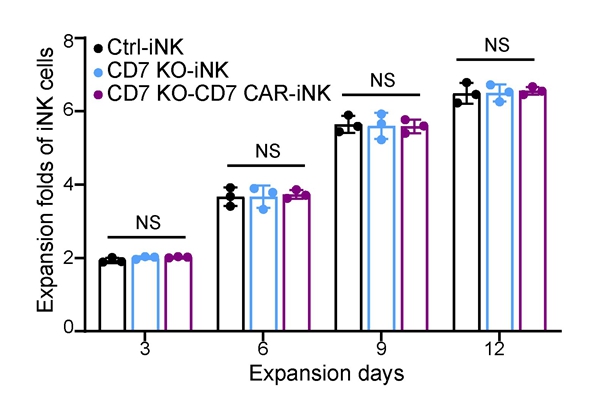
圖2 CD7 KO-CD7 CAR-iNK細胞具備正常NK細胞擴增能力

圖3 CXCR4的過表達延長CRO-CD7 CAR-iNK細胞的體內續存時間
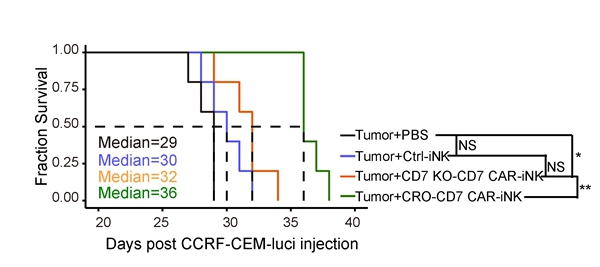
圖4 CRO-CD7 CAR-iNK細胞顯著延長T-ALL細胞荷瘤小鼠的生存期
飲食中加入適量鹽能增添食物的鮮味,但是過多的鹽攝入與人類多種健康問題密切相關,包括高血壓、心血管疾病、腎髒纖維化、骨骼健康受損,以及癌症等。然而,有些野生動物在野外環境中終生取食高鹽植物,卻能夠保...

昆蟲胸部作為飛行功能的核心結構,其外骨骼與特化的飛行肌係統通過直接和間接兩種機製協同驅動翅運動。然而,現有研究往往將形態學特征(如肌肉排列、骨片結構)與飛行運動學參數(如振翅頻率、運動軌跡)割裂分...

羽毛是鳥類征服天空的核心工具。羽毛演化經曆了從恐龍簡單的單根細絲狀羽毛,逐漸變成複雜的羽片狀羽毛,這個過程一般認為分為五個過渡階段,每一個過渡階段都是發展演化新特征或新的生長機製的結果。

