魏妥團隊合作開發摻雜錳佐劑的脾髒靶向mRNA腫瘤疫苗
mRNA疫苗在抗擊嚴重急性呼吸係統綜合症冠狀病毒2(SARS-COV-2)傳染病中的成功,凸顯了該技術在應對突發性傳染病中的應用價值。近些年,mRNA抗腫瘤疫苗的研發也愈發引人注目,因其研發周期短、可實現個性化設計等優點,已開展多項臨床前和臨床試驗,在針對黑色素瘤、非小細胞肺癌和結直腸腫瘤等中有積極療效,帶來顯著的臨床益處。盡管如此,mRNA腫瘤疫苗的有效性仍有很大提升空間,關鍵點在於:1)如何將mRNA精準遞送到抗原呈遞細胞激活特異免疫反應;2)如何提升抗原呈遞效率和免疫激活能力。
2024年10月28日,必威精装版app西汉姆联 魏妥研究組聯合北京大學未來技術學院程強研究組,在《ACS Nano》雜誌在線發表了題為“Spleen-targeted mRNA vaccine doped with manganese adjuvant for robust anti-cancer immunity in vivo”的工作。該研究開發了一種脾髒靶向的mRNA疫苗(Mn@mRNA-LNP),該疫苗將編碼腫瘤抗原的mRNA和錳離子佐劑(Mn2+)同時遞送到脾髒中的樹突狀細胞,從而有效促進了樹突狀細胞的成熟,增強了其表麵相關抗原的呈遞和免疫激活。
此前,研究團隊開發了一種通用的器官選擇性遞送策略,簡稱Selective ORgan Targeting (SORT)技術(Nature Nanotechnology,2020),在這項研究中,研究人員基於SORT技術通過引入不同比例的陰離子脂質(18PA、DOPG和DOPS)作為第五組分來構建和優化一係列脂質納米顆粒(Lipid nanoparticles,LNP),以篩選可實現更高的脾髒靶向效率的LNP。研究團隊發現DOPS LNP特異性靶向脾髒器官的同時,還可以在體內與體外成功地轉染DC細胞,與18PA以及DOPG LNP相比,DOPS LNP在體內誘導了更強大的抗原特異性細胞毒性T淋巴細胞(CTL)反應、Th1與Th2反應。
近期研究發現,Mn2+可作為STING激動劑誘導I型幹擾素(IFN)的分泌以及DC成熟,從而增強抗腫瘤免疫反應。因此,為了進一步增強mRNA疫苗的免疫激活能力,研究團隊嚐試基於Mn2+與DOPS陰離子脂質之間的靜電吸附實現Mn2+的封裝,製備“All-in-One”製劑(Mn@mRNA-LNP)。研究結果表明,DOPS LNP可有效封裝Mn2+,並且Mn2+的摻入不會對DOPS LNP的理化性質和脾髒靶向效率造成明顯影響,反而還提高了mRNA的表達效率、DC的激活能力以及IFN刺激基因的表達。此外,Mn@mRNA-LNP誘導了強大的抗原特異性CTL反應、促進了效應T細胞在腫瘤部位的浸潤以及效應性記憶T細胞的增殖,從而在黑色素瘤、結直腸癌以及手術後腫瘤複發等多種腫瘤模型中均有效抑製了腫瘤增殖。
研究團隊基於“All-in-One”策略開發了一種新型脾髒靶向的治療性mRNA腫瘤疫苗,有效實現了mRNA抗腫瘤疫苗精準遞送至抗原提呈細胞,並且Mn2+的摻入進一步提升了疫苗的抗原提呈效率以及免疫激活能力。同時,該疫苗還具有生產簡單以及安全性高等優勢,為未來治療性mRNA癌症疫苗的臨床轉化提供了一種有潛力的治療策略。
必威精装版app西汉姆联 魏妥研究員與北京大學未來技術學院程強研究員為該研究的共同通訊作者,必威精装版app西汉姆联 博士研究生羅自金為第一作者。該研究得到了北京市自然科學基金、國家重點研發計劃和國家自然科學基金等項目資助。
文章鏈接:https://doi.org/10.1021/acsnano.4c09902

圖1 錳摻雜脾髒靶向mRNA腫瘤疫苗的製備及作用機製示意圖
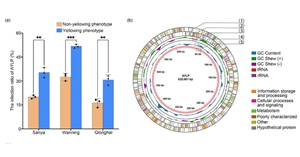
近些年來,海南檳榔黃化病的發生造成檳榔大麵積減產、絕收甚至死亡,嚴重威脅檳榔產業的健康發展。多年來,海南檳榔黃化病病原不清、檢測手段缺失以及傳播途徑未知造成了針對性防控手段的缺失,使海南檳榔黃化病...

多倍化或全基因組重複在生物多樣性演化中扮演重要角色,然而也有研究認為多倍化是生物演化的隨機事件。回答多倍化是否為適應性演化的結果亦或隨機事件,關鍵在於理解多倍體類群建立和形成的過程。

真核生物的轉錄組由大量蛋白編碼mRNA、非編碼RNA和環形RNA等多種分子組成,具有高度的複雜性和多樣性。因此,如何在龐大而複雜的轉錄組中高效、精準地檢測目標轉錄本,成為當前生命科學及醫學研究中的一個重要挑...

