李楊團隊揭示蝙蝠抗病毒RNA幹擾通路介導的免疫耐受機製
蝙蝠能夠攜帶大量病毒但自身往往不出現明顯的病理特征,其中一個關鍵因素是其獨特的免疫耐受能力。這些機製包括抑製過度炎症反應、高效的DNA損傷修複、免疫係統的平衡調控、獨特的幹擾素反應、抗病毒蛋白的作用以及與病毒的長期適應共存。這種複雜而高效的免疫調控機製,使得蝙蝠在麵對病毒感染時,能夠有效地控製病毒,同時避免過度的免疫反應,從而減少對自身組織的損傷,理解這些機製對人類疾病防控具有重要意義。
眾所周知,蝙蝠在飛行過程中需要消耗大量的能量,因此其免疫係統需要在保證有效抗病毒的前提下盡量減少能量消耗。當前,有關蝙蝠免疫耐受的研究主要集中在依賴於蛋白表達的前提下,如幹擾素(IFN)途徑、炎症反應的調節、以及特定免疫基因的表達。那麼蝙蝠是否采用更加節能的方式來抵禦病毒的侵染?2024年8月4日,必威精装版app西汉姆联 李楊團隊在Cell Reports上發表了題為“Increased viral tolerance mediates by antiviral RNA interference in bat cells”的研究工作,揭示了蝙蝠中一種節能的抗病毒免疫耐受機製。
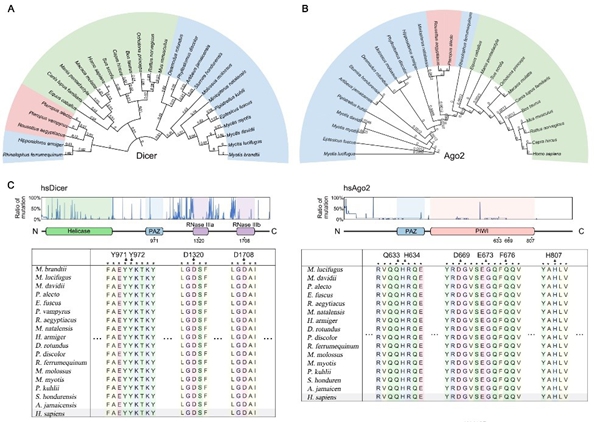
該研究特別關注了蝙蝠細胞中的抗病毒RNA幹擾(RNAi)通路。在采用幾種RNA病毒感染蝙蝠細胞時,細胞中產生了典型的病毒源小幹擾RNA (vsiRNA),相比較於人源細胞,蝙蝠細胞的抗病毒RNAi反應明顯更強。當敲除蝙蝠細胞RNAi通路中的關鍵蛋白Dicer,幾種RNA病毒的複製積累量則大大增加,這種效果在抑製幹擾素通路後依然存在,表明了蝙蝠體內存在著不依賴幹擾素途徑的抗病毒機製。另一方麵,研究發現在Dicer蛋白有效切割病毒源雙鏈RNA(dsRNA)的同時,減少了模式識別受體(例如,RIG-I)的底物, 從而會減弱機體幹擾素反應的啟動,降低下遊的炎症反應。此外,通過體外和細胞實驗,研究發現在較高溫度時,Dicer切割dsRNA效率顯著升高,表明蝙蝠在飛行過程中,由於體溫升高,其體內的抗病毒RNAi有可能具有更高的活力,從而高效切割病毒源dsRNA,保護蝙蝠免受病毒侵染以及防止幹擾素途徑的過度激活。
通過RNAi途徑,蝙蝠能夠在病毒早期感染階段高效地抑製病毒複製,而不需要過度依賴能量消耗大的幹擾素途徑。相比於之前主要關注幹擾素和炎症調節的研究,該工作揭示了RNAi途徑在抗病毒免疫耐受中的關鍵作用,從能量角度解釋了蝙蝠通過這種高效、低能耗的免疫方式在攜帶病毒時仍能保持健康狀態的科學意義。打個比方,這種方式更傾向於控製病毒的“火種”,而不是等“火種”發展成“火災”後,再消耗大量的“人力物力”對其進行消除。這種機製的闡明不僅有助於全麵認識蝙蝠在高能耗的飛行過程中有效地控製病毒感染,還為其他動物和人類的抗病毒策略提供了新的研究思路。
必威精装版app西汉姆联 李楊研究員為論文的通訊作者,戴雲鵬博士和王賓賓博士為論文的共同第一作者。該研究得到了杜克-新加坡國立大學(Duke-NUS)醫學院王林發教授的大力支持,也得到了國家自然科學基金、科技部重點研發等項目的支持。
論文鏈接:DOI: https://doi.org/10.1016/j.celrep.2024.114581

表觀遺傳調控對人早期胚胎發育至關重要,但該過程中表觀基因組動態及其作用機理仍有待深入研究。DNA甲基化(5mC)是哺乳動物中重要的表觀遺傳修飾,在體細胞有絲分裂過程中可以被精確地傳遞至子細胞,並作為染色質...
蝠蠅是蝙蝠體表一類專性吸血的寄生蟲,其在蝙蝠種群中分布十分廣泛,目前已知的有五百餘種分布在世界各地,有研究表明單隻蝙蝠攜帶的蝠蠅甚至可以達到數十隻,且已知蝠蠅攜帶有多種病毒。但缺乏對蝠蠅演化適應機...

基因組DNA是生命的藍圖,對基因組DNA實現任意尺度的精準操作代表對生命藍圖進行修改繪製的底層能力,是基因工程技術發展的核心。

