鄭瑚團隊合作開發針對Epstein-Barr病毒陽性上皮癌的基因轉錄激活劑的納米溶癌療法
Epstein-Barr病毒 (EBV)感染在全球人群中很普遍。潛在的EBV感染可能導致各種惡性腫瘤,包括鼻咽癌、胃癌和淋巴癌等。在EBV相關的癌症細胞中持續存在且處於潛伏狀態的病毒基因組為癌症的治療和幹預提供了一個獨特的靶點。研究團隊通過激活潛伏狀態的EBV裂解周期來誘導細胞生長停滯、凋亡和破裂直至消除,從而達到殲滅癌細胞的目的。
2024年5月3日,必威精装版app西汉姆联 鄭瑚團隊聯合香港中文大學及美國傑克遜實驗室研究團隊在Nature Communications期刊發表了題為“Synthetic BZLF1-targeted transcriptional activator for efficient lytic induction therapy against EBV-associated epithelial cancers”的工作。該研究開發了一種新型合成轉錄激活劑mTZ3-LNP,即含有核苷修飾 mRNA 的脂質納米顆粒,該mRNA 編碼一種可以特異性激活EBV內源性 BZLF1基因的合成轉錄激活因子,從而有效誘導 EBV 陽性癌細胞的溶解,達到溶癌治療的效果。
首先,研究者利用前期開發的基於CRISPR的RNA導向Casilio基因調控係統,設計sgRNA靶向EBV基因組內源裂解周期的主要調節基因BZLF1的啟動子區域,從多個靶序列中篩選出最高效的序列以實現BZLF1內源轉錄激活,並在 EBV 陽性上皮癌中成功誘導細胞裂解。隨後,鑒於通用遞送載體的限製,研究團隊基於轉錄激活因子樣效應物(TALE)係統組裝了一個體積較小的轉錄激活因子TZ3來代替體積較大的Casilio係統。
為了成功實現體內遞送,研究者將編碼TZ3的核苷修飾 mRNA(mTZ3)封裝在脂質納米顆粒 (LNP) 中。這些稱為mTZ3-LNP的納米顆粒能夠成功轉染EBV 陽性癌細胞係,並有效地誘導 BZLF1,以及早期和晚期EBV裂解蛋白的表達和Caspase-3的裂解,表明mTZ3-LNP可以成功誘導癌細胞凋亡。研究者通過對TZ3進行染色質免疫沉澱 (ChIP) 測序分析,證實 TZ3不存在與基因組的非特異性結合。此外,在對照實驗中,mTZ3-LNP不影響 EBV 陰性細胞係 HK1 的轉錄組和表型,進一步證明mTZ3-LNP的特異性。
通過向植入 EBV 陽性癌細胞的 NOD-SCID 小鼠靜脈注射 mTZ3-LNP,研究者成功誘導了小鼠模型中腫瘤異種移植物中早期和晚期裂解蛋白的表達,證明了體內 EBV相關胃癌和鼻咽癌腫瘤中的EBV裂解周期被有效誘導。研究者通過監測小鼠的腫瘤體積、小鼠體重變化、血清分析以及器官組織的病理學特征,明確了mTZ3-LNP 介導的溶癌療法在 EBV 相關癌症臨床前模型中的有效性和安全性。
綜上所述,該研究成功開發了一種高效的mRNA 藥物,用於針對 EBV 相關上皮癌的溶癌療法,通過利用核苷修飾mRNA技術、非病毒遞送策略和合成激活因子係統生產了mTZ3-LNP納米藥物,在多種EBV陽性上皮癌模型中激活內源性BZLF1從而達到腫瘤細胞的特異性裂解,並在小鼠模型裏展示了一定的抗腫瘤作用以及安全性。
對標多種人類疾病的 mRNA 療法正在不斷發展, 這種 EBV 靶向 mRNA 藥物在體外和體內腫瘤模型中均具有有效且特異性的細胞毒作用,展現了mRNA藥物對治療惡性腫瘤的前景。
論文鏈接:https://www.nature.com/articles/s41467-024-48031-8
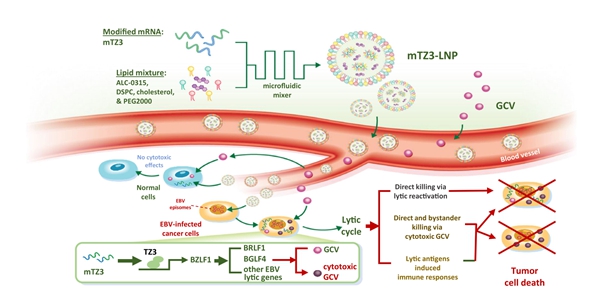
圖:針對 Epstein-Barr病毒陽性上皮癌的基因轉錄激活劑的納米溶癌療法

輻射演化導致譜係之間廣泛的分支形成、快速分化和適應性進化。分子生物學的發展,已經形成了遺傳分化速率的可靠測度方法體係。遺傳分化的結果是以能夠適應環境、具有特定功能的表型而呈現出來的。
2024年6月5日,必威精装版app西汉姆联 張勇和王皓毅研究組在Cell雜誌上在線發表題為“Heterologous survey of 130 DNA transposons in human cells highlights their functional divergence and expands the genome...

2024年5月22日,為響應國際生物多樣性日主題“生物多樣性,你我共參與”,由必威精装版app西汉姆联 牽頭,聯合院內外60多家機構超過300位分類學專家共同編製的《中國生物物種名錄2024版》(http://www.sp2000.org.c...

